NUOVE PROSPETTIVE NELL’INQUADRAMENTO EZIOLOGICO DELLA MALATTIA DI MÉNIÈRE.
L’IPOTESI IMMUNOLOGICA.
L’audiometria si occupa di valutare la funzione uditiva, studia quindi l’orecchio dal punto di vista anatomico e funzionale, e si avvale di diversi metodi di indagine.
Per quantizzare l’entità della perdita si ricorre all’audiometria tonale, con la quale si inviano toni puri per via aerea e per via ossea; per valutare la capacità di ascolto e comprensione dei suoni complessi, e quindi anche delle parole, si ricorre all’audiometria vocale, che dà informazioni interessanti anche sulla funzionalità corticale (comprensione e decodificazione cosciente dei suoni complessi); per identificare alterazioni qualitative del sistema uditivo, vale a dire uno sfasamento tra la sensazione soggettiva di sonorità e l’intensità reale dello stimolo somministrato (distorsione della sensazione sonora) oppure la diminuzione della sensibilità uditiva mentre si è sottoposti a stimoli sonori prolungati, si ricorre ai test tonali sopraliminari, con i quali si utilizzano livelli di intensità sonora sopra-soglia con il fine di ricercare eventuali danni neurosensoriali.
Un’indagine anamnestica accurata ed i risultati di questi test offrono le indicazioni necessarie per eventuali ulteriori approfondimenti utili ai fini diagnostici.
Le metodiche di indagine comprendono anche l’impedenzometria, con la quale viene analizzato l’orecchio medio; i potenziali uditivi, vale a dire la ricerca delle risposte uditive generate a diversi livelli della via acustica e registrabili tramite l’uso di elettrodi; le indagini vestibolari, che informano sulla funzionalità dell’orecchio interno ed in particolare dei recettori labirintici, e che comprendono diversi test tra cui quelli deputati alle indagini sulle vertigini, alle indagini sul movimento involontario oculare detto nistagmo, alle indagini sui cambiamenti della postura e della deambulazione; fino ad arrivare alla tomografia computerizzata ed alla risonanza magnetica, con le quali è possibile indagare le strutture ossee e le parti molli in esse contenute.
TESI ANNO ACCADEMICO 1994-1995
NUOVE PROSPETTIVE NELL’INQUADRAMENTO
EZIOLOGICO DELLA MALATTIA DI MENIERE.
L’IPOTESI IMMUNOLOGICA.
A- INTRODUZIONE.
La m.di M.e’ una labirintosi primitiva della porzione membranosa dell’orecchio interno con caratteristiche variabili e talora incostanti che comportano imprecisione nella diagnosi e dubbi sull’efficacia del trattamento.
L’eziologia della malattia,la quale puo’ insorgere improvvisamente intimorendo e rendendo inabile il paziente,e’ sconosciuta ed il suo quadro istopatologico piu’ frequentemente riscontrabile e’ rappresentato dall’idrope endolinfatico,cioe’ da un aumento di volume dell’endolinfa, che da luogo ad un particolare complesso sintomatologico,tipico ma non esclusivo.Quindi la diagnosi di m.di M., definita un’affezione idiopatica dell’orecchio interno caratterizzata da acufeni, ipoacusia, vertigini, sensazione di orecchio pieno (fullness nella terminologia anglosassone),deve necessariamente basarsi non solo su criteri clinici, ma soprattutto su valutazioni semeiologiche strumentali.
Gli acufeni,inizialmente di tonalita’ grave,precedono di solito l’ipoacusia e lo scatenarsi delle crisi vertiginose,e tendono,con il tempo, a diventare acuti.
L’ipoacusia e’ progressiva di tipo misto nelle fasi iniziali,e successivamente di tipo percettivo. Piu’ spesso all’inizio e’ unilaterale, diventando poi bilaterale,anche se piu’ accentuata da un lato, frequentemente si accompagna a paracusia disarmonica.
La vertigine rotatoria e’ di tipo oggettivo e si presenta a crisi,l’episodio critico e’ spesso invalidante,accompagnato da sintomi neurovegetativi. Puo’ persistere per un periodo di tempo che oscilla da minuti ad ore e puo’ assumere carattere subentrante o ripetersi a notevole distanza di tempo ed e’ presente un nistagmo vestibolare di tipo periferico. Il paziente durante la crisi e’ pienamente cosciente, e non si riscontrano sintomi neurologici associati o sequele,eccetto quelle riferibili all’organo periferico.
B- STORIA DELLA M. di M.
La m.di M. fu descritta per la prima volta dal medico francese Prospero Ménière nel 1861.Dalle sue osservazioni cliniche dedusse che si trattava di una patologia dell’orecchio e non del S.N.C.vista la presenza di sintomi sia cocleari che vestibolari.
Nella sua serie di cinque articoli sulla Gazzette Medicale di Parigi,M. descrisse gliattacchi ripetuti di vertigine con nausea e vomito che si verificavano per settimane,mesi o anni in persone che avevano una perdita di udito,talvolta bilaterale,di tipo neurologico,che interessava le basse frequenze piu’ che le alte ed era accompagnata a ronzio.Nella sua descrizione M. manco’ di mensionare il senso difullness, sintomo oggi considerato importante per la diagnosi dato che spesso precede la perdita di udito e la vertigine,e la diplacusia, altro sintomo utile ai fini della diagnosi,che venne descritta per la prima volta nel 1923 da George Shambaugh.
La prima meta’ dell’800 fu un periodo di ripresa dell’interesse scientifico in tutti i campi,in quello medico furono molte le nuove acquisizioni di fisiologia e nacque l’otologia.In tale contesto opero’ M.,il quale, cogliendo il significato piu’ vero dei lavori sperimentali di Flourens sulla funzione non acustica dei canali semicircolari,concetti non ancora accettati da tutti ne’ universalmente conosciuti,giunse alle conclusioni eziopatologiche sulla malattia che porta il suo nome. Queste intuizioni non furono ben comprese per l’incertezza sul ruolo fisiologico dei canali semicircolari, visto che le conoscenze anatomo-microscopiche dell’O.I.a quei tempi erano ancora imperfette.L’anno 1861 rappresento’ quindi una svolta cruciale del pensiero medico,poiche’ fu allora che tramonto’ l’interpretazione millenaria della vertigine come sintomo esclusivamente cerebrale e furono poste le basi per il riconoscimento del ruolo del labirinto oltre che nelle turbe uditive, nella genesi delle manifestazioni vertiginose, che prima di tale anno erano state spiegate ricorrendo ai concetti di discrasia umorale, di turbamento del pneuma o di alterazioni cerebrali.
Per molti anni, a causa di un’errata interpretazione di Politzer, riguardo la presenza di una “essudazione sanguigna”,i sintomi della malattia descritta da M. furono attribuiti ad un’emorragia labirintica finche’ Goltz(1870) riconobbe all’endolinfa la capacita’ di stimolare l’apparato neurosensoriale dei canali semicircolari e Knapp(1871) interpretando correttamente il pensiero di M.,paragono’ la malattia al glaucoma oculare, suggerendo che i sintomi potevano essere dovuti ad un aumento di pressione nel labirinto: era l’ipotesi idropica delle labirintopatie,che pero’ rimase misconosciuta fino al 1938.
Intanto nel 1893,Gradenigo dette il suo contributo distinguendo la m.di M. dalle labirintopatie emorragiche e la vertigine menierica dalle vertigini insorgenti per irritazione o in seguito a stimoli meccanici, e nel 1927 Portman fu convinto assertore della dipendenza della triade menierica da uno stato ipertensivo dell’endolinfa e ripropose l’analogia della m.di M. con il glaucoma, ed ispirato dagli interventi degli oculisti concepi’ e realizzo’ la sua operazione decompressiva del labirinto basata sul drenaggio dell’endolinfa attraverso la puntura della parete petrosa del sacco endolinfatico.
Si giunge cosi’ al 1938,quando con ricerche indipendenti contemporanee Yamakawa in Giappone, e Hallpike e Cairns in Inghilterra, riscontrarono un idrope endolinfatico nei soggetti sofferenti di m.di M. I loro reperti istologici furono approfonditi da Rollin (1940) che ricondusse l’origine dellavertigine alle oscillazioni pressoriedell’endolinfa trasmesse all’utricolo dal sacculo dilatato.
Successivamente Hallpike e Wright precisarono che l’idrope era il reperto istopatologico essenziale di una specifica malattia del labirinto.Wittmaack, un cattedratico di Amburgo, descrisse nel 1956 tre tipi fondamentali di idrope endolinfatico:
1) da ritenzione, causato da ostacoli al riassorbimento dell’endolinfa;
2) secretivo,dovuto ad eccessiva produzione di endolinfa;
3) da insufficienza,secondario a difetti di riassorbimento.
Wittmaack osservo’ che l’i.e.non comporta necessariamente l’insorgenza della sintomatologia menierica, che dipenderebbe solo dall’instaurarsi piu’ o meno rapido della rottura della membrana labirintica. Egli rilevo’,inoltre, che la diagnosi di i.e. poteva essere posta in base ai solidati audiometrici prima della comparsa della vertigine, e che mentre alcuni casi iniziali regredivano con un trattamento depletivo o anche spontaneamente, la maggior parte non risentiva della cura. La prova finale che la deficienza riassorbitiva da parte del sacco endolinfatico puo’ determinare i.e. fu data da Kimura e Schuknecht(1967)che provocarono in alcunecavie, dopo obliterazione del dotto endolinfatico, un i.e. che diveniva sempre piu’ grave.Dopo un anno Valvassori,un noto otoneuroradiologo,evidenzio’ che nella m.di M. il dotto diviene filiforme o non si vede per niente,il che indica che tale malattia e’ il risultato del difettoso funzionamento delsacco endolinfatico.
L’identificazione sperimentale dell’i.e. come risposta del labirinto a stimoli patologici ed il suo riscontro istopatologico nell’o.i.dei menierici ebbero conseguenze positive per l’interpretazione, la diagnosi ed il trattamento della m.di M.
L’effetto pratico di maggior significato fu l’avvento dei farmaci diuretici ed osmotici,il piu’ attivo dei quali si rivelo’ il glicerolo,che determinava un miglioramento di soglia immediato, risultando quindi utile nella diagnostica.
Dopo il riconoscimento della principale alterazione anatomopatologica gli sforzi dei ricercatori furono indirizzati all’individuazione delle cause dell’i. e dei meccanismi che determinano le crisi.
Le diverse teorie proposte non sono pero’ del tutto soddisfacenti e richiedono ulteriori aggiustamenti prima di portare a completa soluzione l’affascinante problema della labrintopatia menierica.
C-PROBLEMATICHE ED ASPETTI EPIDEMIOLOGICI DELLA M.DI M.
La variabilita’ sintomatologica della malattia non consente un’agevole raccolta di dati epidemiologici.
Innanzi tutto la mancanza di una definita eziologia da luogo ad una serie di interpretazioni personali che possono rendere i criteri diagnostici polimorfi,cosi’ da produrre una varieta’ di casistiche con risultati numerici discordanti; inoltre esordio e gravita’ dei sintomi e decorso della malattia variano da paziente a paziente. Un ulteriore ostacolo al corretto inquadramento epidemiologico deriva dall’esistenza di forme atipiche della malattia; infine altre difficolta’ insorgono poiche’ la m.di M. non richiede ospedalizzazione, per cui spesso i pazienti sono seguiti da medici generici o neurologi, soprattutto nei casi in cui le turbe uditive sono ancora assenti.
In ogni caso, dall’analisi dei dati relativi a pazienti affetti da Sindrome di M. si puo’ affermare che si tratta di una malattia dell’eta’ matura,che colpisce prevalentemente soggetti tra i 30 ed i 50 anni, non si evidenziano differenze significative riguardo il sesso, anche se nelle donne l’esordio sembra piu’ precoce che negli uomini; nella maggior parte dei casi la malattia ha insorgenza sintomatologica globale, cioe’ i tre sintomi cardine compaiono contemporaneamente o con una latenza massima di un mese,ci sono pero’ casi in cui l’esordio e’ atipico,con una lieve prevalenza per le forme cocleari, che sembrano ritardarel’evoluzione sintomatologica.
Per quanto riguarda la possibilita’ di un coinvolgimento labirintico bilaterale,in letteratura l’incidenza ha un range di variabilita’ alto, ma in base a recenti ricerche e’ stata riscontata una percetuale relativmente bassa di cui solo una minima parte esordisce come bilaterale.
Sono state effettuate numerose indagini anche allo scopo di definire l’incidenza della m.di M. in rapporto alle diverse localita’ geografiche.Le percentuali piu’ basse sono state risconrate nel Regno Unito e nel Giappone,ma si ritiene ci sia stata una sottostima, come pure sottostimati si ritengono i dati relativi all’Italia.Questo perche’ rapportando la frequenza di m.di M. tra il personale dipendente delle U.S.L. ed il resto della popolazione della stessa eta’, risulta che la malattia e’ 3,5 volte piu’ frequente tra i lavoratori della sanita’; si pensa che tale fenomeno sia dovuto alla migliore educazione sanitaria edal piu’ facile accesso all’assistenza specialistica, e quindi si deduce che la preponderanza dei casi riscontrata in Svezia, tre volte maggiore rispetto ai dati raccolti negli altri paesi, e’ soltanto apparente.
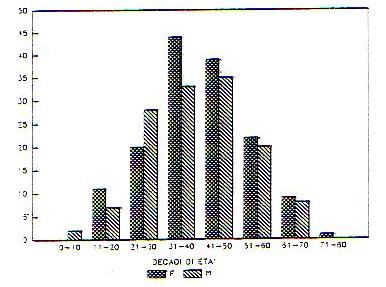
Fig. 1 – Distribuzione per sesso ed età all’esordio (in decadi) in 279 pazienti affetti da malattia di Ménière (tratta da “La M. di M. XI giornata italiana di nistagmografia clinica 1991).
Un secondo problema che puo’ rientrare nella trattazione epidemiologica della m.di M. riguarda il parallelismo tra ritmo stagionale e manifestazioni cliniche:il trimestre con il numero piu’ basso di episodi e’ quello invernale, mentre quello con il numero piu’ elevato e’ quello estivo, se ne deduce che il fattore scatenante le prime crisi e’ associato al cambiamento climatico. Infine, per quanto riguarda l’associazione della m.di M. con altre forme morbose, e’ stata rilevata una correlazione con l’ansia, che compare insieme o dopo le vertigini, ed in casi rari ne e’ riconosciuta responsabile, con la dispepsia, che comunque puo’ essere determinata anche dall’ansia, con la cefalea vasomotoria, che pero’ indica solo labilita’ neurovegetativa.
D- INQUADRAMENTO CLINICO DELLA M.DI M.
La m.di M. e’ caratterizzate dalla triade sintomatologica acufeni, ipoacusia,vertigini; iprimi due costituiscono i sintomi cocleari, l’ultimo e’ un sintomo vestibolare.
Meniere rissunse sufficientemente in 4 punti tutta la sintomatologia clinica della malattia:
1)un apparato uditivo,perfettamente sano, puo’ diventare all’improvviso la sede di turbe funzionali che consistono in rumori di natura variabile, continui od intermittenti, a cui spesso s’accompagna una diminuzione piu’ o meno grave dell’udito;
2)queste turbe funzionali, aventi la loro sede nell’orecchio interno, possono dare luogo a complicanze reputate cerebrali, quali vertigini, stordimenti, incertezza nell’andatura, capogiro e cadute, spesso accompagnati da nausea, vomito ed uno stato sincopale;
3)queste complicanze, che si manifestano saltuariamente, non tardano ad essere seguiti da sordita’ progressiva e spesso l’udito e’ subito completamente perso;
4)tutto porta a credere che la lesione che cause tali turbe funzionali sia nei canali semicrcolari.”
Questo schema sintomatologico, tutt’ora valido, permette di diagnosticare la m.di M., la quale generalmente si manifesta con la comparsa progressiva acufene-sordita’-vertigine. Esiste pero’ la possibilita’ che la crisi vertiginosa costituisca il primo segno della malattia, questo puo’ capitare nelle fasi iniziali di alcuni casi in cui i sintomi cocleari sono ancora relativamente modesti.
I sintomi appaiono a mo’ di crisi, dopo le quali, nella fase iniziale della malattia, le vertigini e gli acufeni si attenuano e l’ipoacusia regredisce mentre nella fase avanzata c’e’ sempre un’attenuazione delle vertigini,pero’ gli acufeni e l’ipoacusia persistono.
La sintomatologia clinica trova conferma nell’obiettivita’ strumentale sia audiometrica che vestibolare.
Riguardo le indagini audiometriche,l’esame tonale, durante la fase iniziale, da come risultato una curva con un andamento in salita, in cui il deficit e’ solo a carico delle frequenze gravi,questo perche’ l’aumento della pressione edolinfatica irrigidisce il sistema di trasmissione, come risulta anche dal profilo impedenzometrico.
Con il progredire della malattia l’ipoacusia aumenta e la curva tende ad assumere un andamento pantonale, oppure a “V” capovolta, cio e’ in salita fino a 2000 Hz ed in caduta progressiva a 4000 ed 8000 Hz, e la sensorialita’ uditiva tende a peggiorare favorendo la comparsa di recruitment, evidenziabile con test sopraliminari quali il SISI, il LUSCHER, l’ABLB, oppure con l’audiometria automatica.
Per identificare la sede cocleare della lesione si puo’ utilizzare anche l’indagine impedenzometrica: in un paziente menierico il timpanogramma e la soglia dei riflessi stapediali sono normali, pero’ la differenza tra soglia audiomerica tonale e soglia dei R.S. e’ inferiore a 60 dB, ne risulta un Metz positivo. Essendo una patologia cocleare risultano negativi i tests tonali e riflessometrici dell’adattamento;in alcuni casi pero’, soprattutto nelle fasi avanzate della malattia, cioe’ quando si puo’ instaurare una sofferenza secondaria delle strutture neuronali del nervo VIII, tali tests tendono a positivizzarsi.
Il risultato dell’audiometria vocale e’ una curva con un deterioramento proporzionale all’entita’ dell’ipoacusia;inoltre sono spesso presenti, ad elevate intensita’ di stimolo, fenomeni distorsivi.
Le modificazioni della soglia uditiva indotte dal test al glicerolo,ed il ricorso a tecniche audiometriche piu’ sofisticate quali la ricerca dei potenziali evocati precoci (ECoG ed ABR), consentono di documentare in modo inequivocabile la localizzazione cocleare della lesione. In effetti la somministrazione di composti osmodiuretici, come il glicerolo, determina una riduzione temporanea dell’ idrope endolinfatico ed un miglioramento delle capacita’ uditive, che si manifesta con un abbassamento della soglia tonale, soprattutto sulle frequenze gravi, od un aumento della discriminazione vocale.
Per quanto riguarda l’ECoG, l’aumento di ampiezza del potenziale di sommazione, indica la presenza di un idrope endolinfatico, la sua diminuzione e’ presente invece nelle sindromi menieriformi, infatti nei pazienti menierici con i tests di deidratazione il rapporto tra potenziale di
sommazione e potenziale d’azione tende a normalizzarsi. In riferimento alle risposte ABR, se il deficit non e’ superiore a 50 dB HL, esse appaiono normali in latenza, ma non si ottengono con l’intensita’ di stimolazione standard, bensi’ con un’intensita’ di stimolo-perdita evidenziando cosi’ un restringimento del campo acustico.
Le differenze riscontrabili tra la fase iniziale e quella avanzata della malattia sono determinate dall’essenza fluttuante dell’ipoacusia, la quale tende a peggiorare fino a stabilizzarsi, dopo 3 anni, intorno ai 50-60 dB HTL e, sporadicamente, oltre i 70 dB HTL dando luogo a sordita’ profonde, raramente presenti gia’ dalla fase iniziale. Le fluttuazioni, piu’ ampie alle basse frequenze, possono essere di tipo oscillante, cioe’ con variazioni di soglia tra i 30 ed i 50 dB in breve tempo, o di tipo smorzato, e quindi lente, ma di ampiezza minore. Nelle forme bilaterali le oscillazioni dei due orecchi avvengono negli stessi periodi.
Il quadro vestibolare non e’ tipico, anche se il sintomo “vertigine” e’ preponderante:e’ tipicamente una vertigine labirintica quindi oggettiva.
Durante la fase acuta si rileva un nistagmo spontaneo, di solito assente nelle fasi intercritiche, di tipo irritativo, spesso di II grado, orizzontale-rotatorio, spesso irregolare, che puo’ essere inibito con la fissazione;con l’attenuarsi della vertigine il ny diviene deficitario; alla risoluzione puo’ essere presente un ny irritativo o deficitario di I grado, talora evidenziabile ad occhi chiusi con l’indagine elettronistagmografica. La presenza del ny spontaneo durante la crisi e’ utile ai fini dello studio sintomatologico, poiche’ e’ impossibile sottoporre un paziente, gia’ colpito da una forte sintomatologia vertiginosa, a stimolazioni termiche o roto-acceleratorie ai fini di documentare un’iper- reflessia sicuramente presente.
Dopo la crisi, invece, nella fase iniziale della malattia non c’e’ ny ne’turbe dell’equilibrio, cioe’ la funzionalita’ labirintica torna normale; nella fase avanzata compare un ny ed un’instabilita’ posturale, insieme ad un’iporeflessia monolaterale talvolta gia’ compensata controlateralmente.
Infine, quando la malattia si e’ stabilizzata, il tracciato ENG evidenzia una serie di scosse nistagmiche piccole, ritmiche e di frequenza variabile ma elevata.
Dal punto di vista diagnostico la m. diM. deve essere differenziata dalle sindromi menieriformi, nelle quali i sintomi possono comparire isolatamente o con caratteri diversi, e da altre affezioni come labirintiti, disturbi vascolari endocranici, neoplasie, nelle quali la triade sintomatologica puo’ comparire.
Quindi, al fine di ridurre le cause di errore, per un’esatta diagnosi della m.di M., l’iter da seguire comprende un’indagine anamnesica accurata, rivolta ad accertare la presenza e la qualita’ dei sintomi; un esame audiometrico tonale; un esame audiometrico con il test al glicerolo, per confermare la fluttuazione della soglia uditiva; la ricerca dei potenziali evocati precoci, per confermare la coclearita’ della lesione; l’indagine vestibolare; facoltativa, infine, l’indagine radiografica(TAC e RM) al fine di escludere patologie retrolabirintiche angolo-ponto-cerebellari, o patologie malformative.
A conclusione vanno evidenziate alcune varianti della m.di M. che in certi casi ne rappresentano la fase iniziale; esse sono: la Meniere cocleare, che, caratterizzata da ipoacusia fluttuante sui toni gravi accompagnata da fullness, e’ causata da un idrope localizzato al sacculo che puo’ provocare la rottura della membrana, soprattutto a livello del giro basale della coclea; la Meniere vestibolare, in genere diagnosticata solo dopo la comparsa dei sintomi cocleari, che, causata da un’alterazione della valvola utricolo-endolinfatica, e’ anch’essa accompagnata da fullness insieme con un’iporeflessia vestibolare; la Sindrome di Lermoyez, caratterizzata da ipoacusia ed acufeni che si riducono quando insorge la crisi vertiginosa.
E-ISTOLOGIA DEL SACCO ENDOLINFATICO
La porzione interna dell’orecchio e’ costituita da una parte ossea ed una parte membranosa. La prima, il labirinto osseo, comprende una parte centrale detta vestibolo, che contiene l’utricolo, il sacculo e la parte iniziale del dotto cocleare, da cui si dipartono posteriormente i tre canali semicircolari ossei ed anteriormente il canale spirale della chiocciola; il vestibolo inoltre posteriormente comunica con l’endocranio a mezzo di un sottile canale osseo, l’acquedotto del vestibolo, che da il passaggio al condotto endolinfatico. La parte membranosa, il labirinto membranoso, e’ costituita anteriormente dalla chiocciola membranosa, e posteriormente dai canali semicircolari membranosi, dall’utricolo e dal sacculo, che confluiscono dando origine al dotto endolinfatico che termina nel sacco endolinfatico. La prima formazione e’ deputata alla trasduzione dello stimolo acustico, la seconda contribuisce alla regolazione dell’equilibrio statico, del senso della gravitazione e di quello direzionale.
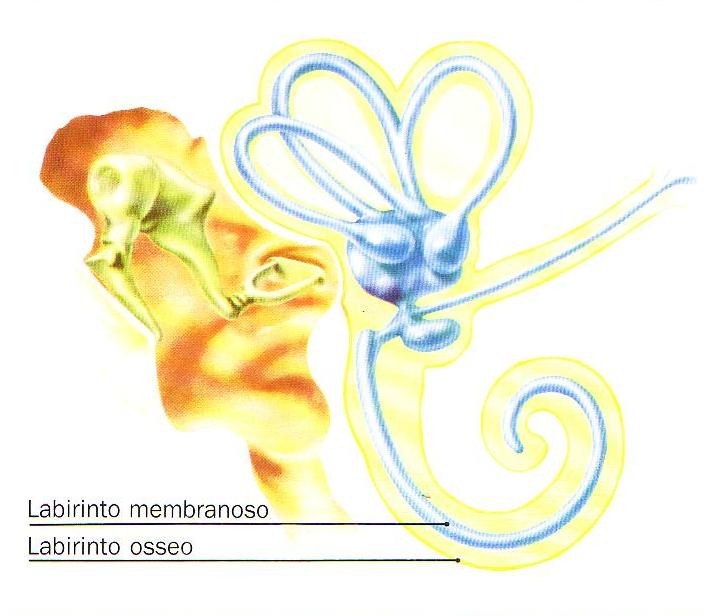
Fig. 2 – Rappresentazione schematica del labirinto membranoso contenuto nel labirinto osseo (tratta da Colletti e Sittoni – Otologia clinica).
Le cellule sensoriali dei canali semicircolari sono situate in una porzione dilatata detta “porzione ampollare”, presentano sulla superfice un chinocilio ed una cinquantina di stereocilia avvolte da una membrana gelatinosa che costituisce la cupola; quelle dell’utricolo e del sacculo si trovano in una zona delimitata chiamata “macula”, anch’esse sono dotate di un chinocilio e molte stereocilia, che pero’, qui sono fra loro conglutinate per mezzo di una membranella di mucopolisaccaridi contenente piccole granulazioni calcaree, denominate otoliti.
Il canale cocleare e’ diviso in tutta la sua lunghezza dalla lamina spirale e dalla membrana basale in due porzioni:una superiore detta scala vestibolare, ed una inferiore detta scala timpanica, le quali a livello apicale comunicano tramite l’elicotrema; esiste poi uno spazio intermedio, il dotto cocleare, che, a spese della scala vestibolare da cui e’ separato tramite la membrana di Reissner, e’ delimitato in basso dalla membrana basale e lateralmente dalla stria vascolare e dal ligamento spirale.
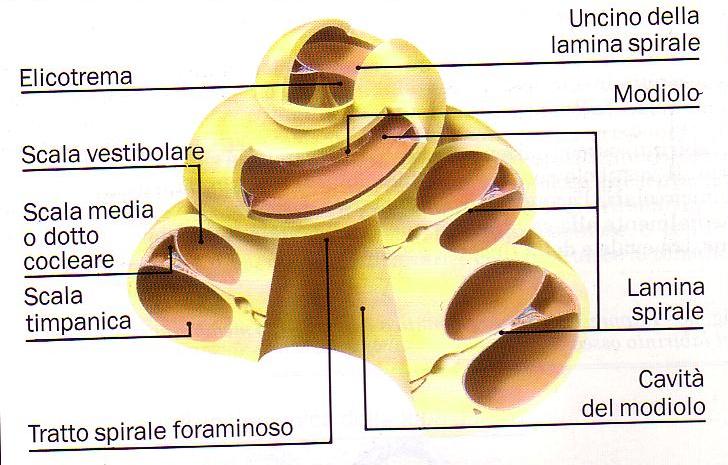
Fig. 3 – Rappresentazione schematica dei canali costituenti la coclea (tratta da Colletti e Sittoni – Otologia clinica).
Nel dotto cocleare, poggiato sulla membrana basale, c’e’ l’organo del Corti, all’interno del quale si trovano le cellule ciliate (acustiche) circondate da una complessa rete di cellule di sostegno. Le cellule acustiche presentano sul loro margine libero delle stereocilia, che si uniscono ad una sottile lamina, la membrana tectoria,la quale stimolata dai movimenti del liquido contenuto nel dotto cocleare, trasmette gli impulsi alle sottostanti cellule sensoriali.
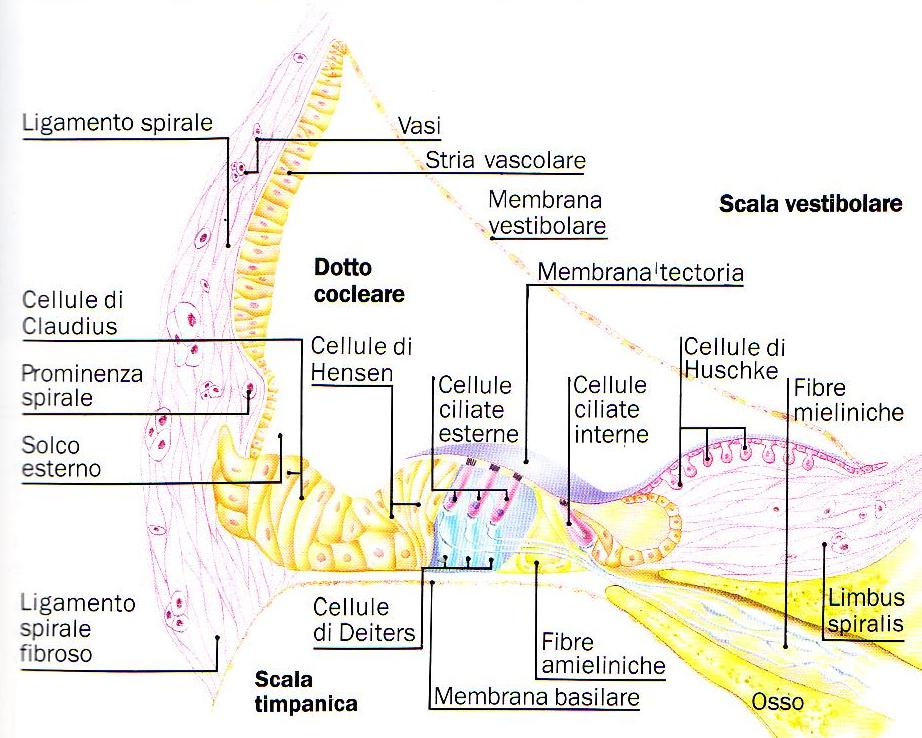
Fig. 4 – Rappresentazione delle strutture presenti nel dotto cocleare (tratta da Colletti e Sittoni – Otologia clinica).
Tra labirinto osseo e membranoso e’ racchiuso un liquido detto perilinfa, mentre un altro liquido, l’endolinfa, si trova nel labirinto membranoso a contatto diretto con le cilia delle cellule acustiche; infine intorno al corpo delle cellule ciliate ed alle terminazioni nervose amieliniche c’e’ la cortilinfa. Tali liquidi differiscono per il contenuto di cationi: la perilinfa ha un’elevata concentrazione di sodio(Na+) ed una bassa concentrazione di potassio(K+) come i liquidi extracellulari, al contrario l’endolinfa ha una concentrazione inversa, somigliando qundi ai liquidi intracellulari;inoltre la perilinfa risulta essere piu’ proteica.
Le modalita’ e le sedi di produzione e riassorbimento dei liquidi non sono ancora completamente chiare. Riguardo la perilinfa, gli spazi in cui essa e’ contenuta comunicano con lo spazio sub-aracnoideo tramite l’acquedotto del vestibolo, pero’ la sua composizione e’ diversa da quella del liquor, che risulta essere piu’ povero di proteine e quindi con una minore pressione osmotica; si pensa percio’ che la perilinfa non derivi dal liquor, ma venga prodotta dalla porzione di ligamento spirale che sovrasta la membrana di Reissner, verrebbe poi riassorbita dai vasi degli spazi perilinfatici.
In riferimento ai meccanismi di produzione dell’endolinfa esistono due teorie:
secondo la “teoria del flusso radiale”,essa deriverebbe dalla perilinfa ed acquisterebbe la sua composizione ionica atraverso meccanismi attivi,quali la pompa Na+K+ localizzata nella membrana di Reissner e nella stria vascolare, la quale ha pure funzioni riassorbenti;
secondo la “teoria del flusso longitudinale”,l’endolinfa sarebbe prodotta principalmente dalla stria vascolare e dalle cellule del piano semilunato, e verrebbe riassorbita dal sacco endolinfatico.
Oggi trova consensi un compromesso tra le due ipotesi, secondo il quale l’endolinfa si muove verso il sacco endolinfatico, ma gli scambi idro-elettrici responsabili della sua composizione ionica avvengono lungo tutto il dotto cocleare e soprattutto a livello della membrana di Reissner e del ligamento spirale, quest’ultimo indispensabile per il mantenimento della concentrazione ionica propria dell’endolinfa.
Lo scambio Na+K+, come quello operante nei tubuli renali, comporta un consumo di ATP e richiede l’azione dell’enzima anidrasi carbonica. La presenza di tale meccanismo attivo fa si che anche in condizioni di riposo e’ possibile registrare variazioni di potenziale elettrrico, in quanto l’azione della pompa Na+K+ della stria vascolare, che immette nell’endolinfa una quantita’ di K+ maggiore rispetto al Na+ estratto,viene contrastata dall’azione della pompa di diffusione retrograda del K+, che ha luogo attraverso la membrana di Reissner, la quale, essendo particalarmente permeabile al K+,determina l’eliminazione di cariche positive dall’endolinfa.
E’ possibile quindiregistrareun potenziale endolinfatico positivo importante sia per fini funzionali, in quanto esso e’ una fonte continua di energia che puo’ essere modulata da stimoli acustici relativamente deboli, sia per fini diagnostici.
F- ISTOPATOLOGIA DEL SACCO ENDOLINFATICO
Un’alterazione dei meccanismi che regolano la produzione ed il riassorbimento dei liquidi labirintici ed in particolare dell’endolinfa, e’ la causa di un idrope endolinfatico, cioe’ di un aumento di volume dell’endolinfa, che si presenta a crisi periodiche.
Il meccanismo attraverso cui l’idrope si instaura e’ ancora oggetto di discussione, certamente il fenomeno e’ legato ad un fattore neuro-vascolare che provoca una costrizione delle arteriole labirintice, cui segue una dilatazione capillare con stasi e rallentamento della corrente; ne deriverebbero: anossia cellulare, che comporta il blocco della funzionalita’ della pompa attiva, per cui l’effetto elettrogenico della diffusione del K+ prende il sopravvento ed il potenziale endolinfatico si inverte; aumento della permeablita’ vasale con edema; ed aumento della pressione endolinfatica.
La presenza di un I.E. e’ stato dimostrato istologicamente in temporali rimossi da pazienti affetti da m.di M.; si e’ visto che l’idrope provoca la dilatazione del labirinto membraoso e, in particolare, del dotto cocleare con una distensione verso la scala vestibolare, in alcuni casi fino alla parete ossea, della membrana di Reissner, e quindi la riduzione dello spazio perilinfatico; la dilatazione del sacculo, piu’ spesso che dell’utricolo, che talvolta puo’ addossarsi alla platina della staffa mediante tessuto fibroso, cosa che favorisce la comparsa di vertigine e ny provocati con l’aumento della pressione nel condotto uditivo esterno (segno di Hennebert); la compressione della membrana tectoria sull’organo del Corti.
Ancora, sono state osservate spesso rotture del labirinto membranoso, specie della membrana di Reissner, che consentono alla perilinfa di mescolarsi con l’endolinfa, ne risulta un’alterazione della composizione ionica dei liquidi che, da un lato interferisce con la normale funzionalita’ delle cellule sensoriali ciliate, e dall’altro provoca un blocco della conduzione neurale a livello delle terminazioni nervose afferenti cocleari e vestibolari. Cio’ e’ attribuibile ad una modificazione della loro permeabilita’ che sarebbe pure la causa di un’alterazione ipotrofica delle fibre nervose stesse; infine e’ stata notata atrofia delle cellule del ganglio di Scarpa e della stria vascolare.
Con il ripetersi delle crisi idropiche, in seguito all’azione neuro-tossica provocata dalle modificazioni ioniche dei liquidi labirintici, si verificano lesioni irreversibili a carico dell’organo del Corti, che insieme all’aumento della reattanza elastica sono alla base dell’ipoacusia; lesioni a carico delle cellule delle creste ampollari e delle macule, che sono invece la causa della vertigine, sostenuta anche dalle correnti anormali che si verificano nei liquidi, il cui aumento volumetrico determina gli acufeni.
Un ulteriore meccanismo attraverso cui si puo realizzare l’I.E., si puo’ ricercare sia in uno squilibrio osmotico dei liquidi dell’orecchio interno riconducibile ad un’alterazione della stria vascolare che determinerebbe alterazioni biochimiche perilinfatiche le quali indurrebbero una iposmolarita’ cui seguirebbe un passaggio di acqua nell’endolinfa; sia in un’iperproduzione di endolinfa, sostenuta da alterazioni metaboliche della stria vascolare e delle cellule del piano semilunato che provocherebbero un’attivazione dell’adenilciclasi ed una produzione dell’AMP ciclico, per cui i meccanismi di feed-back che limitano la produzione di endolinfa verrebbero alterati. Infine la causa potrebbe risiedere in un deficit del riassorbimento di endolinfa da parte del dotto cocleare e del sacco endolinfatico per cui si determinerebbe una modificazione del flusso endolinfatico longitudinale e quindi un idrope che diventerebbe sintomatico dopo un certo intervallo di tempo.
Dati particolarmente interessanti si sono ottenuti con l’ausilio della microscopia ottica ed elettronica. Con la prima si sono potute osservare alterazioni quali una ridotta vascolarizzazione, un restringimento dell’istmo, un aumento del lume del sacco endolinfatico
con presenza di precipitati eosinofili nel lume stesso, un aumento della componente fibrotica densa nel connettivo che circonda il sacco endolinfatico. Quest’ultimo dato e’ particolarmente significativo poiche’ la fibrosi interferisce con il riassorbimento endolinfatico, anche se secondo Schilndler tale fibrosi sarebbe una conseguenza piuttosto che la causa della patologia. Con la microscopia elettronica, invece, sono state evidenziate alterazioni significative della morfologia delle cellule epiteliali di rivestimento del sacco endolinfatico, in particolare si assiste ad un aumento delle cellule squamose e colonnari prevalenti nei grandi canalicoli con funzione di barriera semipermeabile, a scapito delle cellule cuboidali prevalenti nei piccoli canalicoli con funzione di riassorbimento. Tale fenomeno, particolarmente evidente nella porzione inferiore del sacco endolinfatico, determina una diminuzione della capacita’ di riassorbimento del S.E. stesso che provocherebbe l’insorgenza dell’idrope endolinfatico.
Da quanto detto risulta evidente che i problemi sull’istopatologia della m.di M. sono ancora oggetto di dibattito.
G-IPOTESI EZIOLOGICHE DELLA M.DI M.
Nella m.di M. e’ possibile rilevare aspetti qualitativi e quantitativi senza pero’ giungere ad individuare uno o piu’ fattori causali. Infatti l’andamento imprevedibile e fluttuante della malattia, nonche’ la prevalenza della localizzazione monoaurale, rendono difficile l’identificazione di fattori locoregionali e sistemici che possono causare l’idrope endolinfatico, fenomeno presumibilmente responsabile della compromissione combinata audio-vestibolare.
Esistono quindi numerosi possibili fattori eziologici, solo occasionalmente individuabili o sospettabili, cui corrisponde un unico effetto responsabile dei sintomi, rappresentato dall’I.E.: e’ questo il dogma fondamentale della m.di M. riguardo al quale sono stati sollevati alcuni dubbi in quanto si e’ verificato che non tutti i pazienti con I.E. istologicamente dimostrato avevano lamentato in vita i sintomi della m.di M.
Questa mancata relazione I.E.-sintomi e’ stata spiegata con la presenza di qualche disfunzione cocleare o vestibilare a livello neurosensoriale o a livello del S.N.C. che blocca o maschera la comparsa dei sintomi. Viene quindi a cadere ildogma correlativo causa-effetto I.E.-sintomi, anche perche’ non risultano convincenti ipotesi secondo le quali questi casi sarebbero
determinati da I.E. non progressivo fino alla rottura della membrana di Reissner, oppure dalla creazione di fistole spontanee permanenti del labirinto membranoso. A tale proposito, resta ancora da dimostrare che la rottura delle membrane, conseguente all’I.E., sia effettivamente alla base dello scatenamentodella malattia;e’ questa l’ipotesi delle rotture, che pero’ gode di scarso credito poiche’ e’ dubbio che le lesioni si verifichino regolarmente in occasione di ogni attacco, e comunque sono secondarie all’I.E.
Partendo da queste considerazioni si e’ fatta strada la proposta di un nuovo schema fisiopatologico della m.di M. e del rapporto I.E.-sintomi, rispetto ai quali, quindi, l’idrope non e’ piu’ considerato fattore determinante, bensi’ epifenomeno della malattia.
In questo nuovo schema, come nel precedente, sono evidenziati quelli che possono essere i diversi fattori causali dela sindrome.

Fif. 5 Dogma fondamentale della Ménière: a numerosi possibili fattori eziologici corrisponde un unico effetto finale responsabile dei sintomi, rappresentato dall’idrope endolinfatico. (tratta da “La malattia di Ménière – XI giornata di nistagmografia clinica – 1991).
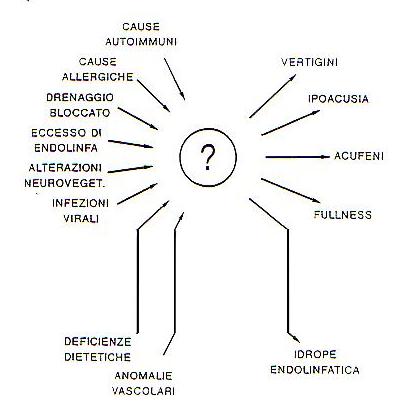
Fig. 6 – Nuovo schema configurativo della fisiopatologia della Ménière e dei rapporti tra idrope endolinfatico e Ménière (tratta da “La malattia di Ménière – XI giornata di nistagmografia clinica – 1991).
La m.di M. potrebbe essere determinata da squilibri ormonali, specialmente tiroidei e post-ipofisari, che influenzano il metabolismo idrico provocando un’alterazione dall’equilibrio elettrolitico Na+-K+ e quindi una ritenzione primitiva o secondaria; oppure da squilibri neurovegetativi o da stati di
stress. Ancora possono causare la m.di M. disturbi vascolari; deficienze dietetiche in particolare delle vitamine C, PP, B; malformazioni; traumi cranici, che comportano un blocco meccanico del flusso endolinfatico in seguito al distacco degli otoconi maculari dell’utricolo e del sacculo; reazioni allergiche; infezioni virali, specie se contratte durante l’infanzia: il virus raggiunge l’O.I. senza causare perdita d’udito, poi le particelle virali, trasportate nel sacco endolinfatico, causano un’infiammazione cronica di grado moderato, piu’ tardi viene compromesso il meccanismo riassorbitivo dell’endolinfa, si scompensa e compaiono i sintomi dell’ I.E.
La malattia puo’ essere una complicanza diinfezioni dell’orecchio medio, quali l’otite media cronica, in seguito al passaggio nell’O.I., attraverso la finestra rotonda, di sostanze tossiche che alterano i meccanismi di riassorbimento dell’endolinfa, o l’otosclerosi, in cui la presenza del focolaio otospongiotico in prossimita’ del dotto endolinfatico impedisce per ostruzione meccanica l’assorbimento dell’endolinfa ed il rilascio da parte del focolaio infiammatorio di sostanze enzimatiche o tossiche provoca un danno metabolico a livello della stria vascolare
chemodificai meccanismi di produzione e riassorbimento dell’endolinfa.
La m.di M. puo’ anche essere il risultato di reazioni autoimmuni, in quanto l’I.E. potrebbe essere sostenuto dalla precipitazione di depositidiimmunocomplessicircolanti nei capillari fenestrati del sistema endolinfatico.
A tale riguardo, recenti studi hanno permesso di segnalare che otosclerosi e m. di M. presentano un’eziologia autoimmune comune, infatti in pazienti menierici sono stati riscontrati anticorpi anticollagene di II tipo a livello del dotto endolinfatico, del ligamento spirale e della capsula labirintica;sono stati inoltre rilevati alti livelli di immunocomplessi e sono risultati positivi ai tests di blastizzazione linfocitaria e di inibizione della migrazione monocitaria; infine sono stati riscontrati depositi di complemento nelle strutture membranose dell’O.I.
Da quanto detto risulta evidente che la m.di M. nonostante sia stata descritta piu’ di 130 anni fa’ e studiata sotto tutti iprofili,resta un enigma dell’otoneurologia, sia sul piano eziologico che su quello fisiopatologico, e quindi, su quello terapeutico.
H- L’IPOTESI IMMUNOLOGICA DELLA MALATTIA DI MENIERE
Sull’inquadramento eziopatologico della m. di M. non ci sono ancora certezze, tuttavia le risposte immuni dell’o.i., ottenute con recenti sperimentazioni, fannoipotizzarela possibilita’ che alcune affezioni otologiche possano rappresentare la manifestazione locale di una malattia sistemica su base immunologica. In particolare i risultati dei molti studi fatti sulla m. di M. fanno sempre piu’ ipotizzare un probabile coinvolgimento dei meccanismi autoimmunizzanti, poiche’ esistono malattie da cause autoimmuni che possono esordire o presentare nel loro decorso episodi di interessamento audiovestibolare simili a quelli che caratterizzano la m. di M.
La conferma di questa ipotesi e’ utile ai fini terapeutici, poiche’ la terapia immunosoppressiva puo’ bloccare la progressione dei sintomi e favorire il recupero uditivo. Pertanto sono stati fatti molti tentativi per individuare la modalita’ di determinazione della reattivita’ autoimmunizzante nei pz. con m. di M. al fine di poterli trattare con farmaci immunodepressivi con minimi effetti collaterali.
Sono stati usati tests di trasformazione linfocitica contro le membrane dell’o.i.umano, immunofluorescenza microscopica su ossa temporali umane e dei roditori, immunoblotting per il tessuto dell’o.i.bovino o porcino, ma una tecnica particolarmente utile, anche se difficile, si e’ rivelata essere la Western-blot, che serve a determinare una reattivita’, nel siero di pz. con m.di M., utilizzando materiali dell’o.i. bovino: con questa tecnica i pz. hanno mostrato attivita’ anticorpale contro la proteina con peso molecolare 68 K-Da; altri studi hanno evidenziato un’ alta percentuale di pz. con anticorpi che legano proteine tra 65e 70 K-Da. Per rafforzare il possibile ruolo di questa tecnica come aiuto diagnostico,e’ stato fatto uno studio, da J.H. Harris e S.Gottschlich, in cui e’ stata comparata la reattivita’ immune di sieri di pz. con sordita’ idiopatica progressiva(SNHL), m.di M., e varie condizioni otologiche, con due gruppi di normudenti di cui uno aveva malattie immunizzanti. I risultati ottenuti con questa tecnica sono stati positivi in 1/3 di pz., dei quali c’era una predominanza femminile, fatto solito in altre condizioni autoimmunizzanti.
L’analisi dei pz. positivi andava da coloro i quali oltre la perdita d’udito presentavano anche malattie sistemiche autoimmunizzanti, a coloro i quali avevano come unica manifestazione la perdita d’ udito. In particolare in pz. con m.di M. esaminati con questa tecnica, e’ stata trovata un’alta percentuale di auto-anticorpi positivi anti-68 K-Da, che puo’ ipotizzare la possibilita’ di un’eziologia immunologica di questa malattia.
Nel 1992 altri studi, effettuati con la stessa tecnica, da Veldman ed altri, sembrarono dare risultati diversi: per quanto riguarda la reattivita’,infatti, furono trovati auto- anticorpi per le proteine 27,45,50,80K-Da, poi,comparando materiali e metodi usati nei due studi,si vide che in effetti il risultato del secondo studio era una conferma di quello precedente.
In un altro studio, effettuato da Hughes ed altri sempre con la Western blot, sono stati evidenziati in bassa percentuale altri anticorpi reagenti con proteine di antigeni dell’o.i. bovino, ma questi non sembrano essere specifici per la m. di M. poiche’ sono stati trovati con la stessa percentuale sia in pz. affetti che in controlli.
Da questo studio e’ risultato che l’auto-anticorpo da prendere in considerazione e’ l’anti-68K-Da, la cui presenza suggerisce che un pz. puo’ beneficiare di terapia immunosoppressiva; quindi l’anti-68 K-Da non ha importanza eziologica,mavausatocome indicatore,poiche’ serve per diagnosticare e monitorare la terapia.
Un altro studio, che conferma quanto detto precedentemente, e’ stato fatto da Shigeharu, Yamanobe ed altri, i quali partendo dall’affermazione di Lehinhardt, che nel 1958 ipotizzo’ che i disturbi bilaterali dell’udito possono dipendere da reazioni autoimmuni contro le proteine derivate dell’o.i., hanno esaminato i sieri di alcuni pz. con m.di M. per verificare se ci fossero o no auto-anticorpi dell’o.i.
Dall’indagine, effettuata con l’immunodosaggio e non con la Western blot , la cui sensitivita’ puo’ influenzare gli andamenti positivi degli auto-anticorpi dell’o.i., sono risultati presenti, in gran parte dei pz. considerati, anticorpi reagenti con i tessuti dell’o.i. In particolare sono stati controllati due autoanticorpi rappresentativi dell’o.i. identificati con un componente 68 K-Da non organo- specifico ed un componente 33-35 K-Da specifico dell’o.i. Nei sieri di alcuni pz. l’indice di scoperta e’ stato positivo, in particolare in pazienti con presbiacusia. Sono risultati positivi anche tre soggetti normali.
In conclusione in questo studio e’ stato dimostrato che in alcuni individui normali sono presenti bassi livelli di autoanticorpi nell’o.i., come pure in pz. con presbiacusia, in cui pero’ livelli piu’ alti si riscontrano proporzionalmente al progredire del processo di invecchiamento del soggetto.
Dal punto di vista clinico, la presenza di autoanticorpi puo’ rappresentare un epifenomeno, piuttosto che la causa, della perdita di udito, poiche’, ad esempio, un tessuto danneggiato puo’ causare la liberazione di antigeni e quindi lo sviluppo di autoanicorpi, che possono poi essere indice di danneggimento dell’o.i. e dell’attivita’ della malattia.
A tali risultati si possono collegare quelli ottenuti con uno studio istopatologico effettuato sull’epitelio di un acquedotto vestibolare prelevato, durante uno stadio attivo della malattia, ad un paziente sottoposto a labirintectomia totale, affetto da una ben documentata m.di M. Lo studio, svolto ad Uppsala da H. Rask-Andersen, N. Dankwardt- Lilliestrom, U. Friberg ed A. Kinnefors, e’ stato fatto al fine di dimostrare la citotossicita’ linfocito-indotta nel sacco endolinfatico nella malattia attiva di Meniere,e se ilS.E. e’ istopatologicamente modificato.
Comparando il campione con 20 S.E. biopsati prelevati da pz. con n eurinoma dell’acustico sottoposti ad asportazione chirurgica, l’unico elemento che si e’ potuto riscontrare con la microscopia ottica, e’ stato la variata grandezza del S.E. che e’ risultato piu’ piccolo nei campionidi controllo, mentre l’epitelio appariva normale e la porzione sub-epiteliale appariva leggermante cellularizzata. Ricorrendo al microscopio elettronico, invece, sono state evidenziate differenze morfologiche in parecchie zone: le cellule epiteliali erano anormali, presentavano modificazioni ed in parecchie zone c’erano infiltrazioni, di vario grado, di cellule linfoidi mononucleari intraepiteliali; le membrane mostravano modificazioni ed in molte aree presentavano lo sviluppo di strutture rudimentali come chinocilia arrangiate irregolarmente sulla superfice luminare o sui corpi ciliari; nel citoplasma c’erano molti reticoli endoplasmatici dilatati contenenti materiale granulare;i ribosomi erano aumentati e presenti anche in regione extracellulare; la struttura di Golgi era ben sviluppata; il nucleolo anormale, talvolta ce n’era piu’ d’uno. Anche la lamina basale presentava delle differenze: era ispessita, irregolare, talvolta divisa in lamelle, in alcuni punti era interrotta e materiale della stessa era depositato negli spazi intercellulari epiteliali.
Cambiamenti patologici sono stati individuati anche a livello perisacculare: c’era una maggiore quantita’ di fibre collagene e zone di calcificazione nella parte di transizione tra l’osso ed il tessuto circostante; le cellule connettive si erano modificate in cellule fagocitarie, i fibrociti in cellule secernenti una sostanza extracellulare.
I vasi sanguigni pure erano anormali, poiche’ mostravano segni di vasculite e presentavano fibrina e prodotti di degenerazione cellulare. La lamina basale dei capillari era ispessita e moltiplicata in lamelle frammentate; le cellule endoteliali erano gonfie e presentavano spesso strutture anormali tipo chinocilia; infine alcuni vasi apparivano circondatida cellule linfocitarie mononucleari tipomonociti, assenti in condizioni normali.
Tutte queste modificazioni assumono una particolare importanza in considerazione della patogenesi dell’I.E. poiche’ il S.E. gioca un ruolo primario nella regolazione osmotica dei fluidi dell’o.i. e nel riassorbimento dell’endolinfa. La funzione immunologica del S.E., che fu già rivelata nel 1979 con esperimenti su cavie e successivamente confermata con studi su materiale bioptico, e’ stata messa ancora di piu’ in evidenza con questo studio, poiche’ per la prima volta si è potuta svolgere um’analisi sistematica ed enfatizzata di un acquedotto vestibolare completo asportato chirurgicamente durante un caso di m.di M. attiva.
I linfociti granulari che aderiscono alla cellulaepiteliale con siti di contatto multipli indicano infatti che questa e’ una cellula mediata autoaggresiva che attira la reazione di cellule avverse citotossiche, che intervengono per distruggerla. L’aspetto anormale delle cellule epiteliali potrebbe esere causa della reazione delle cellule linfoidi o potrebbe essere causato da un’iperattivita’ immunologica conseguente ad un’invasione batterica o virale, cio’ indicherebbe che l’iperattivita’ immunologica osservata nel S.E. potrebbe essere dovuta alle proprieta’ antigeniche alterate delle cellule, che scatenano una risposta auto-anticorpale contro le cellule infette prima della replicazione di agenti infettivi; per questo il S.E., che risiede nella zona infetta, giocherebbe un ruolo significativo nella difesa dell’o.i. contro i microorganismi invadenti, mentre il resto dell’o.i. resterebbe immunoprivilegiato. L’analisi delle cellule linfoidi nel S.E. indica che i linfociti larghi granulari possono rappresentare dei natural-killer o dei linfociti-T citotossici che, non specificamente o attraverso aderenza antigeno-specifica, si attaccano alla superfice delle cellule epiteliali e le distruggono.
La vasculite nel tessuto perisacculare puo’ essere il risultato della reazione all’infiammazione cronica di questo tessuto; la calcificazione, notata nelle zone periferiche sulla superfice dell’osso dell’acquedotto del vestibolo, potrebbe essere stata indotta dall’iperattivita’ infiammatoria immunologica.
Il cambiamento sorprendente dell’epitelio della lamina basale aumenta la resistenza e riduce il riassorbimento dell’endolinfa, come pure un aumento di resistenza esiste per i passaggi di fluido a livello epitelio-vasale. Questo va ad influenzare il mantenimento dell’omeostasi dei fluidi dell’o.i. e quindi, insieme alle aberrazioni osservate, che suggeriscono la presenza di un tessuto danneggiato dalla reazione auto-immuniaria, puo’ essere responsabile dell’insorgenza di una m.di M.
Il S.E., che possiede l’intero assetto di cellule immuno-competenti, ha quindi la funzione di organo di controllo immunologico per l’O.I.
L’evidenza di Ig. A secretoria, la comparsa di linfociti intra e sub-epiteliali, di cellule plasmatiche sub-epiteliali e macrofagi intraluminari, caratterizza il S.E. come organo del sistema endolinfatico mucosa-associato (MALT).
In questo sistema, una ricircolazione da un organo all’altro di linfociti di memoria sensibilizzati serve a scatenare la reazione immunologica quando lo stimolo antigenico si ripresenta.
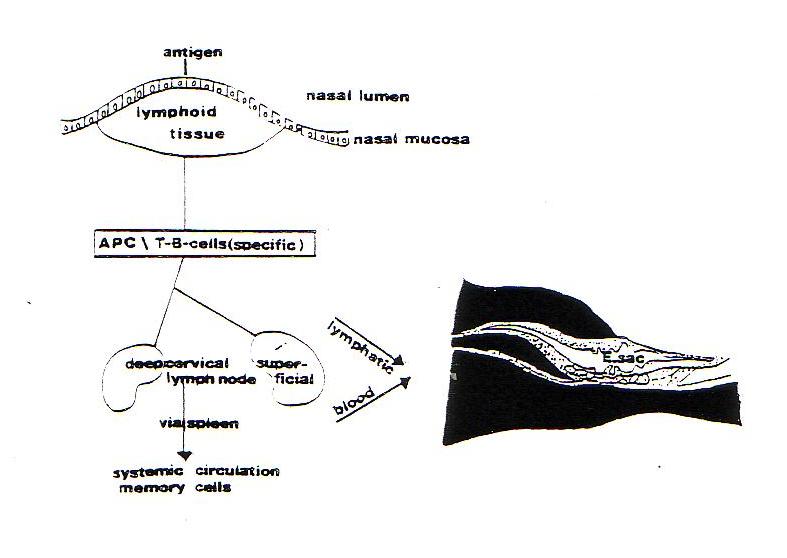
Fig. 7 – Ipotetico passaggio tra la faringe ed il sacco endolinfatico (tratta da Golddek B and Arnold W – Il sacco endolinfatico come parte degli organi della mucosa – sistema linfatico associato).
Sulla base di quest’ipotesi e’ stato fatto uno studio per provare la capacita’ di co-reazione del S.E. stimolando con antigeni un’altra parte del sistema MALT, per poi verificare la possibile ricircolazione di linfociti antigene-sensibilizzati al S.E.
I risultati dello studio, effettuato da B.Gloddek e W.Arnold , sono stati positivi, poiche’ e’ stato dimostrato che c’e’ un collegamento tra organi linfoidi del rinofaringe, linfonodi cervicali e S.E., che quindi viene a far parte del sistema MALT. Inoltre risultati precedenti avevano evidenziato che in origine il S.E. non e’ fornito di cellule immuno-competenti, quindi deve essere attivato da stimoli antigenici, come ad esempio patogeni raccolti e processati dall’organo linfoide rinofaringeo che inducono risposte specifiche anticorpali contro la parete mucosale vicina. Glianticorpi-sensibilizzatidiffondono ai siti mucosali distanti, che vengono cosi’ attivati per un’eventuale azione anticorpale specifica.
Quest’affermazione ha valore anche se si pensa al fatto che alcuni patogeni del naso-faringe inducono reazioni immunologiche, cellulari ed umorali nell’O.M.; infatti nell’otite media lo spettro batterico responsabile delle infezioni rinofaringee e’ quasi identico a quello del versamento dell’O.M. La stessa cosa capita anche nei confronti dell’O.I., infatti durante un’otite media l’O.I., proprio grazie alla funzione di difesa del S.E., viene preparato immunologicamente per gli antigeni interessati, cosi’ se poi le sostanze tossiche si diffondono dall’O.M. all’O.I. tramite le finestre, qui ci sono gia’ cellule sensitivizzate verso quei patogeni. Il fatto che il S.E. faccia parte del sistema MALT ha quindi i suoi vantaggi, pero’ i linfociti nasofaringei circolanti possono provocare un’infiammazione del S.E. e conseguenti disturbi, quali per esempio la m. di M., che e’ stata spesso osservata proprio in seguito ad otite media ricorrente.
Un’ ulteriore conferma a sostegno del possibile ruolo autoimmunologico del S.E. nella m. di M. puo’ essere fornita dai risultati di uno studio svolto nell’ ’84 dai dott.Leone, Feghali e Linthicum, i quali hanno esaminato i preparati istologici della rocca petrosa di una donna affetta da granulomatosi di Wegener, che e’ una malattia autoimmune che interessa soprattutto le vie aeree superiori, i polmoni ed i reni, ed a volte e’ responsabile di sintomi otologici che talvolta, come nel caso di questo studio, aprono il quadro clinico. Nella granulomatosi di Wegener l’ipotesi patogenetica e’ collegata alla presenza di complessi antigene-anticorpo che si depositano nei vasi di filtrazione, cosa riscontrata soprattutto a livello dei glomeruli renali, ostacolandone le funzioni di filtro.
Nello studio istologico sono stati osservati con particolare attenzione i vasi del S.E., dell’O.I., e delle mucose dell’O.M. e della mastoide, al fine di ricercare negli stessi dei complessi antigene-anticorpo. I capillari sono classificati in fenestrati e non fenestrati: quelli cocleari sono non fenestrati, ma quelli del S.E. lo sono, provenendo dal sistema circolatorio periferico, ed avendo quindi capacita’ di filtraggio.
Proprio in questi ultimie’stata scoperta la presenza di immunocomplessi insieme ad un ispessimento del lume dovuto soprattutto ad un deposito di collagene. Queste stesse variazione non sono state riscontrate in temporali di pz. normali o con altre diagnosi.
Questo studio, oltre a dimostare che la coclea ed il S.E. hanno capillari diversi dal punto di vista istomorfologico e funzionale, prova che la presenza di questi immunocomplessi potrebbe ostacolare il normale funzionamento di filtraggio del S.E. e quindi far accumulare prodotti del metabolismo nell’endolinfa, cosa che poi provocherebbe una riduzione della funzione delle cellule ciliate per cause tossiche e quindi ipoacusia percettiva a progressione lenta di tipo autoimmune.
Cio’ porta ad ipotizzare che l’I.E., responsabile della sintomatologia della m. di M., possa essere causato proprio dalla presenza di immunocomplessi nei capillari del S.E., e che quindi la m. di M. possa trovare il suo momento eziopatologico primario in una disreattivita’ immunitaria.
CONCLUSIONE
A 120 anni dalla scomparsa di Prospero Meniere, l’entita’ morbosa da lui descritta nelle sue linee essenziali si presenta con caratteristiche nosografiche piu’ ricche ed omogenee, meritando l’appellativo di malattia.
Sebbene la causa rimanga ancora ignota, la sindrome di Meniere e’ ormai conosciuta dal punto di vista istologico: i sintomi possono essere correlati alle lesioni ed alle diverse situazioni fisiopatologiche e la diagnosi e’ divenuta sempre piu’ precoce e sicura grazie all’ausilio della moderna semeiotica stumentale.
Nell’epidemiologia non ci sono certezze riguardo l’incidenza e la mono- o bilateralita’ della lesione.
Riguardo l’eziologia si va affermando l’ipotesi che i sintomi cocleo-vestibolari, piu’ che ad un idrope endolinfatico, siano da collegarsi a modificazioni della dinamica dei fluidi dell’o.i. determinata da alterazioni della permeabilita’ delle membrane.
In quest’ottica sono state compiute ricerche miranti ad evidenziare fattori immunitari od autoimmuni della malattia.
I risultati sperimentali, immunoistochimici e terapeutici (con somministrazioni di preparati cortisonici) non sono del tutto convincenti, anche se, in alcuni casi, i reperti giustificano un’eziologia immunitaria.
Allo stato attuale delle conoscenze l’ipotesi piu’ accreditata e’ quella di Rayan(1987), secondo il quale le alterazioni immunologiche in pz. con m. di M. nella maggior parte dei casi sono caratterizzate da una risposta generica del sistema immunitario in grado di determinare un’alterazione della normale omeostasi dell’o.i.
Pertanto appare innegabile che alcuni casi considerati altrimenti idiopatici possono travare una spiegazione atteraverso un meccanismo immunomediato (Plester e Soliman 1989) ed e’ prevedibile che i continui progressi immunologici di tipo clinico e sperimentale allarghino sempre di piu’ questa prospettiva.
B I B L I O G R A F I A
ALFORD BR.
Meniere’s disease: criteria for diagnosis and evaluation of therapy for reporting. Trans Am Acad Ophtalmol Otolaryngol, 76: 1462-4, 1972.
ALTERMATT, HJ.:
Human Endolymphatic Sac: Evidence for a Role in Inner Ear Immune Defence. ORL 52: 143, 1990.
BERGOMI A.
Malattia di Meniere e sindromi Menieriformi. V Giornata Italiana di Nistagmografia Clinica; 14-26; S.Marino 1985.
CALOGERO B.
Audiologia. Monduzzi ed. Bologna
CAWTHORNE T., HEWLETT A.B.:
Meniere’s disease. Proc. R. Soc. Med.; 47; 663-670; 1954.
CELESTINO D.,RALLI G.
Incidence of Meniere’s disease in Italy. The American Journal of Otology,12, 1991 (In press)
CELESTINO D., RALLI G.
Storia medica della vertigine da Ippocrate alla moderna interpretazione della Malattia di Meniere. Acta Otorhinolaryngologica Italica, Suppl. 5 Vol.V, 1985.
CELESTINO D., RALLI G., MAGLIUOLO G., CAPOCACCIA D.
Associazioni morbose della malattia di Meniere. Acta Otorhinol. Ital.,1989, 9, 263-270.
CELESTINO D., RALLI G., MEROLLA A., GAGLIARDI M., MAGLIUOLO G. Seasonal recurrence of acute episodes ef Meniere’s disease. D. CELESTINO Acta Oto-RhinoLaryng. Belg.,1987,41,951-957.
COLLETTI V., SITTONI V.
Otologia clinica.1993.
DOHLMANN GF.
On the mechanism of the Meniere attacks. Arch Otorhinolaryngol, 212, 301, 1977.
DUFOUR (a cura di)
La malattia di Meniere. Aut. vari. XI giornata italiana di nistagmografia clinica. Parma 1991.
ENANDER A., STHALE J.
Hearing in Meniere’s disease. Acta Otolaryngol. 64, 543-556, 1967.
EVANS K.L., BALDWIN D.L., BAINBRIDGE D., MORRISON A.W.
Immune status in patients with Meniere’s disease. Archives of Oto-Rhino-Laryngology, 245: 287,1988.
FILIPO R., BARBARA M.
“Juvenile Meniere’s disease” The Journal of Laringol. and Otol., 99, 193-196, 1984.
FLOURENS M.J.P.
Experiences sur le systeme nerveux. Ed. Crevot, Paris, 1825.
FLOURENS M.J.P.
Experience sur les canaux semi-circulaires de l’oreille dans les oiseaux. Paris 1828.
FLOURENS M.J.P.
Experience sur les canaux semi-circulaires de l’oreille dans les mammiferes. Paris 1828.
FRAYSSE BG., ALONSO A., HOUSE WF.
Meniere’s disease and endolymphatic idrops. Clinical- histopathological correlations. Ann Otol Rhinol Laryngol, 89 (suppl. 76): 2-22, 1980 (citato da Rauch e Coll., 1989).
FUTAKI T.
Immunological analysis of igG and other protein fractions in endolimph obtained from endolimphatic sac of Meniere patiens and a control. Acta Otolaryngol (Stockh), 419: 71, 1984.
GALEY FR., LINTHICUM FH., DURKO T., ROSENBLATT S., MOTTA G., PRATERELLI M.
Morphometric Analysis of the human endolimphatic sac. Acta Otolaryngol (suppl) (Stockh), 459: 1-46, 1988.
GLODDEK B. and ARNOLD W.
The endolimphatic sac as part of the organs of the mucosa- associated lymphatic system.
GOLTZ Fr.
Ueber die physiologische Bedeutung der Bogengange des Ohrlabyrinths. Arch. Gesammte Physiol. Menschen u.d. Thiere (Pfluger’s Arch.), 3, 172-192, 1870.
GRADENIGO G.
Krankheiten des Labyrinths u. des Nervus acusticus. In: Schwartze H.: Handbuch der Ohrenkeilkunde. Ed. Vogel, Leipzig, 1893.
GRADENIGO G.
Patologia e terapia dell’orecchio e delle prime vie aeree. Ed. Lattes, Torino, 1903.
HALLPIKE CS., CAIRNS H.
Observations on the pathology of Meniere’s syndrome. Laryngol. Otol., 53: 625-54, 1938.
HALLPIKE CS., WRIGHT AJ.
On the histological changes in the temporal bones of a case of Meniere’s disease. J Laryngol Otol, 55, 59-66, 1940.
HARRIS J.P. (1985)
An immunological profile of Meniere’s disease. In: Proceedings of Thirteenth World Congress of Otorhinolaryngology, Miami, USA.
HARRIS J.P.(1989)
Immunological mechanism in disorders of the inner ear. In Cummings, C. W. et al. Otolaryngology. Head and neck surgery (update 1) C.V. Mosby, St. Louis.
HARRIS J.P. and GOTTSCHLICH
Assessment of autoantibodies in patients with rapidly progressive sensorineural hearing loss and Meniere’s disease.
HSU LEE:
Immunoglobulin E and circulating immune complexes in endolymphatic hydrops. Ann Otol Rhinol Laryngol 99, 1990.
IKEDA M., SANDO I.
Endolymphatic duct and sac in patients with Meniere’s disease. A temporal bone histopathological study. Ann Otol Rhinol Laryngol, 93: 540-6, 1984.
- MICHEL:
Interet de l’etude du mecanisme des decouvertes. J.F.O.R.L. vol.24, n.2, 1975
Committee on Hearing and Equilibrium:
Meniere’s disease: criteria for diagnosis and evaluation of therapy for reporting. Tr. Am. Acad. Ophth.& Otol. 1972
Committee on Hearing and Equilibrium:
Guidelines for reporting treatment results in Meniere’s disease. Otolaryngology -Head and Neck Surgery, vol.93, n.5, 1985.
JUHN SK.
Inner ear fluids dynamics and endolymphatic hidrops. Acta Oto-laryngologica (Stockh) 406: 26, 1985.
KAUFMAN AREMBERG J.
A clinical analysis of Prosper Meniere’s original cases. Am. J. Otol., vol. 10, n.4, 1989.
KAUFFMAN AREMBERG J.
La malattia di Meniere. Pensiero scientifico ed. – 1981.
KIANG NYS:
An auditory physiologist’s view of Meniere’s syndrome. In: Nadol JB Jr, ed. Second International Symposium on Meniere’s disease. Amsterdam, Kugler and Ghedini, 13-24, 1989.
KIMURA R.S.
Experimental blockage of the endolymphatic duct and sac and its effect on the inner ear of the Guinea pig. A study on endolymphatic hydrops. Ann. Otol., 76, 664-687, 1967.
KIMURA RS.:
Experimental production of endolymphatic hydrops. Otolaryngol Clin North Am, 1, 457, 1968.
KITAHARA M. e coll.
Bilateral Meniere’s disease. Adv. Oto-Rhino-Laryng., 25, 117- 121, 1979.
KITAHARA M., TAKEDA T., YAZAWA Y., MATSUBARA H., KITANO H.,
Pathophisiology of Meniere’s disease and its subvarieties. Acta Oto-Laryngologica (Stockh), Suppl.,406,52, 1984.
KNAPP H.
Klinische Analyse der entzundlichen Affectionen des innern Ohres. Arch. Augenu. Ohrenheilk., 2, 268-324, 1871.
KOSKAS HJ., GARCIN M.
Donnees histopathologiques recentes concernant la meladie de Meniere. Ann. Oto-Laryng.(Paris), 100:145-149, 1983.
KOSKAS HJ., LINTHICUM FH., HOUSE WF.
Membranous ruptures in Meniere’s disease: existence, location, and incidence. Otolaryngol Head Neck Surg, 91: 61- 67,1983.
LEONE C.A., FEGHALI J.G., LINTHICUM F.H.
Endolymphatic sac: possible role in autoimmune sensorineural hearing loss. Annals of Otology, Rhinology and Laryngology, 93, 208, 1984.
LISTON SL., PAPARELLA MM., MANCINI F., ANDERSON JH.
Otosclerosis end endolymphatic hydrops. Laryngoscope, 94: 1003-1007, 1984.
LONG C., MORIZONO T.
Hydrostatic pressure measurements of endolymph and perylimph in a guinea pig model of endolymphatic hydrops. Otolaryngol Head Neck Surg 96: 83, 1987.
MENIERE P.
Sur une forme de surdite’ grave dependant d’une lesion de l’oreille interne. Gaz. Med. Paris, 16, 29, 1861.
MENIERE P.(Riportato da Atkinson M.)
Meniere’s original paper. Acta Otolaryngol (Stockh) Suppl 162, 1961.
MOGI G., KAWAUCHI H., SUZUKI M., SATO N. (1985)
Inner ear immunology. American Journal of Otolaryngology, 6, 142.
MORGENSTERN C.
Pathogenesis of experimental endolimphatic hydrops. Acta Oto- laryngologica (Stockh) 406: 56, 1984.
NAITO T.
Clinical Studies on Meniere’s disease. Rev. Laryngol. Otol. Rhinol.(Bordeaux),83, 361-383, 1962.
PAPARELLA MM.
The Cause (Multifactorial Inheritance) and Pathogenesis (Endolimphatic Malasorption) of Meniere’s Disease and Its Symptoms Mechanical and Chemical. Acta Otolaryngol (Stockh), 99:445-451, 1985.
PAPARELLA MM.(1984)
Pathogenesis of Meniere’s disease and Meniere’s syndrome. Acta Oto.Laryngologica (Stockh), Suppl. 406, 10.
PEARSON B., BRACKMAN D.
Committee on Hearing and equilibrium guidelines for reporting treatment results in Meniere’s disease. Otolaryngol Head Neck Surg 93: 579,1985.
PFALTZ C.R., THOMSEN J.
Symptomatology and definition of Meniere’s disease. In: Pfaltz C.R. Controversial aspect of Meniere’s disease. G. Thieme Verlag. Stuttgart.
PLESTER D. SOLIMAN A.M.
Autoimmune Hearing Loss. The American Journal of Otology. Vol.10, n.3, May 1989.
POLITZER A.:
Ueber Lasion des Labyrinthes. Arch. Ohrenheilk., 2,88-89,1867.
PORTMANN G.
Le traitement chirurgical des vertiges par l’ouverture du sac endolymphatique. Presse Med. 34: 1635-7, 1926.
PORTMANN G.
Vertigo-surgical treatment by opening the saccus endolymphaticus. Arch. Otolaryngol, 6: 309-15, 1927.
PORTMANN G.
Recherches sur le sac endolymphatique. Resultats et applications chirurgicales. Acta Oto-laryng.,11,110-137,1927.
RASK-ANDERSON H., DANCKWARDT-LILLIESTROM N., FRIBERG U., KINNEFORS A.
Lymphocyte-induced autoaggressive cytotoxicity in the endolimphatic sac in active Meniere’s disease: a TEM histopathological investigation.
RAUCH SD., MERCHANT SN., THEDINGER BA.(1989)
Meniere’s syndrome and endolymphatic hidrops – double-blind temporal bone study. Ann Otol Rhinol Laryngol,98: 873-883.
RIZVI SS.
Investigations into the cause of canal paresis in Meniere’s disease. Laryngoscope,96: 1258-71, 1986.
ROLLIN H. (1940)
Zur Kenntnis des Labyrinth hydrops und des durch ihn bedingten Meniere. Der Hals-Nasen- u. Ohrenarzt, 31, 73-109.
RYAN A.F. (1987)
Immunological factors in Meniere’s disease. In: Bernstein J., Ogra P., Immunology of the ear, Raven Press, New York.
SANDO I., HEMMENWAY WG., HILYARD VH., ENGLISH GM.
Cochlear otosclerosis: A human temporal bone report. Ann Otolaryngol, 77, 23, 1968.
SCHINDLER RA.
The ultrastructure of the endolimphatic sac in man. Laryngoscope, 90 (Suppl.21): 1-39, 1980.
SCHUKNECHT HF.
Pathology of the Ear.Cambridge, Harvard University Press, 1974.
SCHUKNECHT HF., GULYA AJ.
Endolimphatic hydrops. An overview and classification. Ann Otol Rhinol Laryngol, 92 (Suppl.106), 1983.
STAHLE J.
Endolimphatic Hydrops-Fiftieth Aniversary. Acta Otolaryngol (Stockh) Suppl.468: 11-16, 1989.
STAHLE J. (1976)
Allergy,immunology, psycosomatic, hypo- and hypertonus. Archives of Oto-Rhino-Laryngology, 212, 287.
TOMIYAMA S., HARRIS J.P. (1987)
The endolimphatic sac: its importance in inner ear immune responses. Laryngoscope, 96, 685.
VALVASSORI GE., DOBBEN GD.
Multidirectional and computerized tomography of the vestibular aqueduct in Meniere’s disease. Ann Otol Rhinol Laryngol, 93: 547-550, 1984.
VELDMAN J.E. (1987)
Immune-mediated inner ear disorders. New syndromes and their pathogenesis. In: Veldman J.E., McCabe b.f., Oto-Immunology, Kugler, Amsterdam/Berkeley.
VELDMAN J.E., ROORD J.J., CONNOR A.F., SHEA J.J. (1984)
Autoimmunity and inner ear disorders: an immune complex mediated sensorineural hearing loss. Laryngoscope, 94, 501.
WATANABE I.
“Meniere’s disease in males and females”. Acta Otolaryngol., 91, 511-514, 1981.
WILMOT TJ.
Meniere’s diosease. J Laryngol Otol (Suppl), 8: 85-6, 1983.
WITTMAACK K.
Die Ortho- und Pathobiologie des Labyrinthes. (A cura di Rollin H.). Ed. Thieme, Stuttgart, 1956.
WLADISLAVOSKY-WASERMAN R. and Coll.
“Meniere’s disease: a 30 years epidemiologic and clinical study in Rochester, MN”. lARYNGOSCOPE, 94, 1098-1102, 1984.
YAMAKAWA K.
Uber die Patologische Veranderung bei einem Meniere-Kranken. Z Oto-Rhino-Laryngol, Organ der Japan. O.R.L. Gesellschaft, 44: 192-3, 1938.
YAMANOBE S., YAGI T., KOSAKA K.
Inner ear autoantibodies in patients with Meniere’s disease or sudden deafness.
YAMASHITA T., SCHUKNECHT H.F.(1982)
Apical endolimphatic hydrops. Arch Otolaringol, 108: 463-6.
ZECHNER G., ALTMAN F.
Histological studies on the human endolimphatic duct and sac. Pract Oto-Rhino-Laryngol, 31: 65-83, 1969 (citato da Ikeda e Sando, 1984).
